在国际市场合规运营是跨国药企的核心挑战之一。要确保药品生产和供应链符合全球GMP(药品生产质量管理规范)和GDP(药品分销质量管理规范)标准,企业必须在经过确认的设施中生产、储存和运输产品。本文将解析确认与温度分布验证的核心概念,并结合行业案例和最佳实践,助力跨国药企顺利出海。
一、验证与确认的核心概念
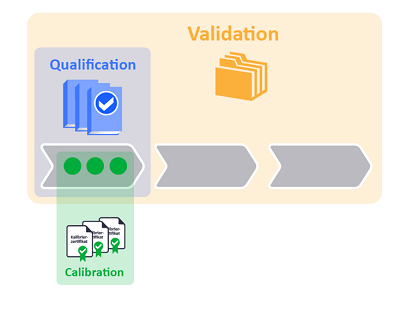
验证(Validation)是对整个过程的深入检查,确保其能够始终如一地实现预期结果。例如,在仓库储存药品时,不仅需要物理设施,还需要符合资质的人员、合规的系统以及必要的设备。所有相关因素必须先经过确认,才能进行验证。
确认(Qualification)侧重于证明设施或设备能够满足预期用途。例如,一个仓库需要始终保持在2至8℃的范围内,确认过程需证明其具备稳定控制温度的能力。这一过程通常分为四个阶段:
- 安装确认(IQ):验证设备是否正确安装。
- 运行确认(OQ):测试设备在各种运行条件下的稳定性。
- 性能确认(PQ):在实际操作环境下评估设备的持续性能。
- 再确认(Requalification):定期评估设备是否仍符合标准。
二、确认的正式要求与行业最佳实践
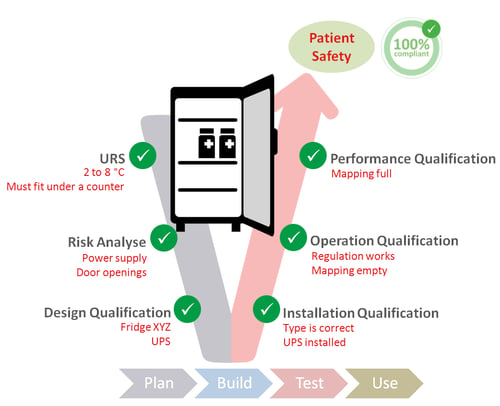
虽然法规对确认没有严格的结构要求,但行业普遍遵循GxP原则,确保清晰的文件记录,并进行充分的风险分析。V模型是确认的最佳实践,涵盖以下阶段:
- 用户需求规格(URS):定义设备的核心要求,如温度范围。
- 风险分析:评估可能影响产品质量的因素,如电力故障、空气流通等。
- 设计确认(DQ):确保采购的设备符合既定规范。
- 运行确认(OQ)与性能确认(PQ):分别测试设备在空载和满载情况下的运行稳定性。
在实际运营中,企业通过紧密结合法规要求与自身独特需求,构建标准化确认流程,已被证明能够有效提升运营效率。诸多企业在引入 V 模型后,优化了仓库温度确认等流程,减少了操作环节,提升了整体效率。
三、温度分布验证:确保存储环境符合标准
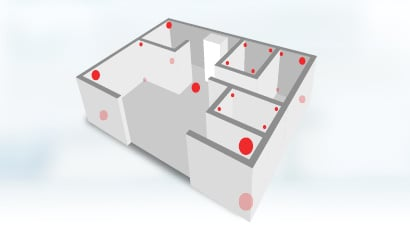
温度分布验证(Temperature Mapping)是确认的一部分,旨在测量和记录储存环境的温度分布情况,以确定最热和最冷点。根据WHO指南,验证网格需遵循两个关键原则:
- 在x、y、z轴上均匀布置传感器。
- 在潜在的热点和冷点(如门口、出风口)额外布置传感器。
验证过程通常需要全面覆盖不同季节、日夜温差等多重影响因素。当制药企业完成温度分布验证,若所有测量点均稳定处于规定温度范围内,则验证大功告成,此时可在关键位置安装监测设备。此外,为进一步强化长期合规性,建议企业引入先进的数据分析工具,持续动态监测温度变化趋势,确保存储环境始终符合严苛标准。
四、设备群组确认:提升运营效率
对于跨国药企而言,优化确认流程至关重要。针对冰箱、培养箱等标准化设备,可采用设备群组确认(Grouping Qualification)方法:
- 按供应商、型号、尺寸等标准将设备分组。
- 选取每个群组中的一台设备进行详细的温度分布验证。
- 其余设备直接进行性能确认,以减少重复工作。
这一方法在行业内获得了广泛认可,大量企业通过采用设备群组确认方法,优化了设备确认流程,在确保合规的同时,有效降低了时间与资源成本。
五、结语
确认和温度分布验证是跨国药企确保GMP/GDP合规的关键环节。通过采用行业最佳实践,企业能够显著提升运营效率,大幅降低合规风险,为全球市场的药品供应链筑牢可靠防线。此外,巧妙融合数字化工具与数据分析,企业还能进一步优化监测与管理流程,全力确保药品在整个供应链中的质量与安全性,为全球患者源源不断地提供高品质的药品保障。

想要了解更多信息,请联系我们