蛋白质浓度的测定是常见的生物实验之一。本文介绍的是使用BCA法(二辛可酸法或二喹啉甲酸法)进行蛋白质浓度的测定。
一、实验原理
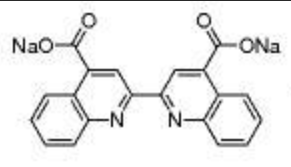
BCA是一种稳定的碱性水溶性复合物。在碱性条件下,蛋白质可以将BCA试剂中的二价铜离子Cu2+还原成一价铜离子Cu+,接着还原出来的Cu+与BCA试剂螯合形成紫蓝色络合物,该络合物在562nm处有强烈的光吸收,且蛋白质浓度和其吸光度在一定范围内(如50-2000μg/ml浓度)是具有良好的线性关系的,因此可以通过制作蛋白质浓度与其在562nm处的吸光度的标准曲线,根据待测蛋白的吸光度对照标准曲线就可计算待测蛋白浓度。
原理图:
第一步反应:

第二步反应:

二、实验步骤
- 实验器材:可调分光光度计、恒温水浴箱、移液器、移液管、试管若干
- 实验试剂
- 试剂A:含1%BCA二钠盐、2%无水碳酸钠、16%酒石酸钠、0.4%氢氧化钠、0.95%碳酸氢钠,将上述液体混合后调pH到11.25。
- 试剂B::4%硫酸铜溶液。
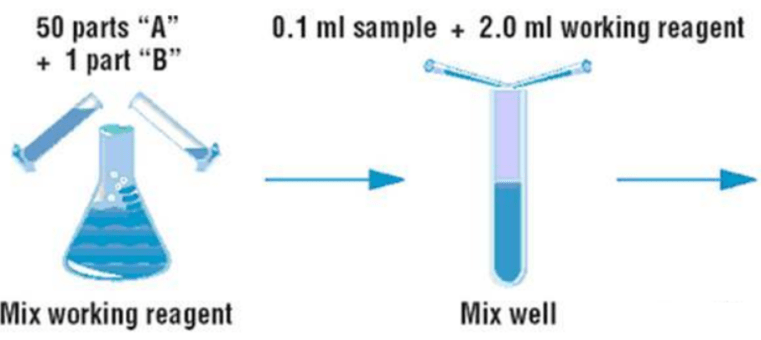
- BCA工作液:将试剂A和试剂B先分别摇晃混匀,然后按照50:1的比例配置BCA工作液,之后再充分混匀并在24小时内使用。
- 蛋白质标准液:可选用牛血清白蛋白(BSA)作为标准蛋白。准确称取150mg牛血清白蛋白,溶于100mL蒸馏水中,即得5mg/mL的蛋白质标准液。之后还可以分别吸取不同容量的标准液并与蒸馏水混合稀释成不同浓度的蛋白质标准液。
- 待测样品。
- 实验操作
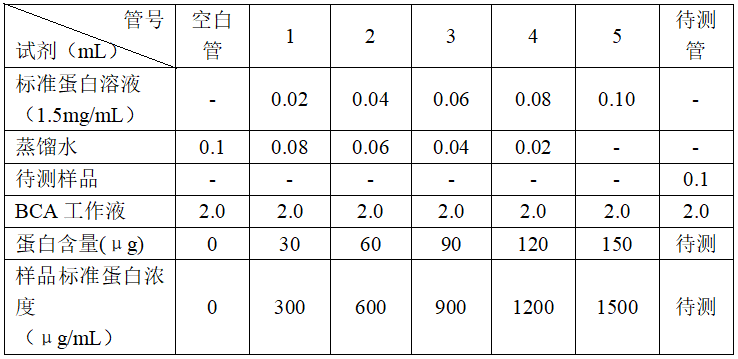
- 选取7支洁净试管,其中5支标号1-5号管,其他2支分别标签空白管和待测管。按照下表用移液器准确移取相应的标准蛋白溶液或待测样品、蒸馏水和BCA工作液于试管中。
注意:稀释后的标准蛋白溶液或待测样品与BCA工作液混合比例应为1:20。
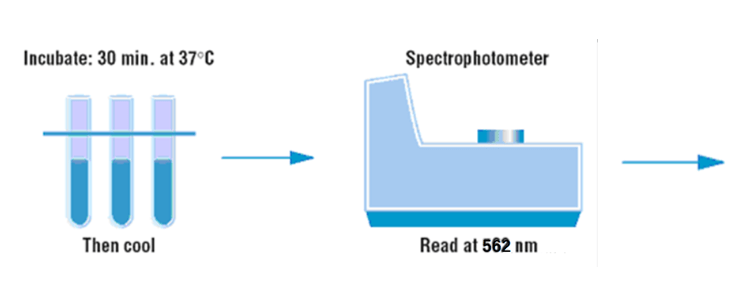
- 将上述各试管混匀后置于恒温水浴锅中37℃保温30分钟;
- 然后吸取各试管中的溶液于比色皿中并用分光光度计的562nm波长比色测定吸光度值;
- 以蛋白质含量或者浓度为横坐标,吸光度值为纵坐标绘制标准曲线;
- 将测得的待测蛋白吸光度值代入标准曲线,就可计算得出蛋白质含量或者蛋白质浓度。
操作过程示意图:

三、方法优缺点
优点:
- 此方法被广泛选用,操作简便、准确,灵敏度高,试剂稳定性好;
- 不易受一般浓度去污剂影响,抗干扰能力强;
- 检测不同蛋白质分子的变异系数也远小于考玛斯亮蓝法;
- 在20-2000μg/mL浓度大范围内具有良好的线性关系。
缺点:
- 可能会受螯合剂和高浓度还原剂的影响;
- 需要30分钟或者更长时间的恒温水浴孵育

