1 摘要
1.1 实时机械生物学研究挑战
在病原体与人体之间复杂的相互作用过程中,机械信号发挥着重要作用,它决定着基因表达、黏附动力学,甚至形态发生。从细胞外基质的密度、泌尿道中流体流动的剪切力,到血管的迂曲程度,机械生物学领域与基础生物学过程紧密交织。然而,要实时捕捉这些动态变化,尤其是在像肠道这样复杂的微环境中,一直是一个难题,因为共聚焦显微镜的成像速度太慢,无法对肠道蠕动进行成像 [1] 。
1.2 肠道芯片模型
器官芯片(OoC)技术的发展为研究机械生物学事件开辟了新的契机。该技术所构建的微型生态系统能够以极高的保真度模拟生理条件,尤其适用于研究那些仅在人类中出现且无法在动物模型中复制的病症。通过整合多种细胞类型以及有助于维持体内平衡条件的多孔膜,器官芯片平台在引入诸如流体流动和蠕动等关键要素的同时,还能模拟器官的微观结构。但要获得全面的研究见解仍面临诸多障碍,尤其是在实现实时三维成像以及研究瞬时事件方面。
该研究涉及两种病原体的入侵机制:
1.2.1 溶组织阿米巴变形虫(导致阿米巴病)
阿米巴病是由溶组织阿米巴变形虫引起的,溶组织阿米巴变形虫是一种专门攻击人类的寄生虫。虽然许多感染没有症状,但一旦寄生虫突破肠道内壁,就会引发疼痛性腹泻,并伴有出血和溃疡形成。更严重的话,阿米巴病可能会升级为肝脏、肺和脑等重要器官脓肿的形成。
正在破坏人类结肠的粘液层-282x300.png)
1.2.2 志贺氏菌(导致志贺氏菌病的细菌)
志贺菌病由志贺菌感染引起,志贺菌是大肠杆菌的不同变种。这些细菌携带着一种毒力质粒,使其能够仅侵入人类肠道上皮细胞,随后侵入黏膜层。这种入侵会引发严重的炎症,并伴随着广泛的组织损伤。

2 研究目的
这项工作目的是在周期性变形条件下对芯片器官进行四维实时成像,模拟肠道的蠕动运动。除了实现可视化之外,这种方法还能揭示组织的流变学特性,为深入了解机械应力的时空分布提供了新的视角。该研究以肠道屏障为重点,展现了机械信号与病原体侵袭之间的相互作用,突出了溶组织内阿米巴和志贺氏菌的致病机制。
研究观察了多种参数:宿主细胞的死亡情况、组织的连接性、病原体的追踪、入侵及定殖情况,以及应力相关性。
3 实验设置
3.1 材料
- 肠道芯片
- T2i 旋转盘共聚焦显微镜
- ORCA-Flash 4.0 数字 CMOS相机
- OB1 MK3+ 流量控制器
- MSF 流量传感器
- Elveflow 软件界面
3.2 4D实时成像优化
首先,在蠕动条件下获取视频面临多项挑战,本研究已解决:
- 对齐问题:视频序列通常与周期性蠕动运动不同步。为了解决这个问题,有必要将其对齐到一个四维数据堆栈中,同时要考虑到周期之间的时间延迟。
- 组织曲率:组织的曲率可能导致图像失焦,这就需要进行二维投影处理。
运动校正:可能发生平面外运动,需要运动校正技术来确保成像准确。
3.3 肠道芯片感染实验
肠道芯片包含两个腔室。上腔室灌注有培养基,并培养着Caco2细胞,而下腔室则专门用于灌注培养基。一块横向的膜能够进行机械拉伸,以模拟肠道的蠕动运动。随后通过向该系统中注入受感染的培养物,从而实现了细菌和类变形虫的感染。
3.4 微流体蠕动应力设置
该微流控装置通过点成Elveflow的 ESI 软件进行监控,并使用 OB1压力控制器在三通道设置下进行监测(见图 4):
- 通道 1:向肠道芯片的顶部通道灌注培养基,该通道内含有Caco2细胞(源自人类结肠的上皮细胞)。连接MFS流量传感器(流速为每小时30微升)。
- 通道 2:向肠道芯片的底部通道灌注培养基。连接MFS流量传感器(流速为每小时30微升)。
- 通道 3:进行侧向真空拉伸操作,以模拟结肠的蠕动(幅度为10%,频率为0.15Hz)。

与众多全球领先的品牌合作,不仅是虹科对高品质高新技术的认可与追求,更是对每一位客户承诺的体现——始终致力于为每一位客户提供最可靠的技术支持与服务保障。
4 主要发现
实验控制参数说明:WP:存在类似蠕动的拉伸;WOP:不存在类似蠕动的拉伸;福氏志贺菌 – mxiD:无毒菌株;TSAR 福氏志贺菌菌株在三型分泌系统(T3SS)激活时会表达绿色荧光蛋白(GFP)(这是毒力基因诱导的标志物,可使细菌侵入宿主细胞);半胱氨酸蛋白酶抑制剂(E64)可抑制变形虫对细胞膜的降解作用。
4.1 组织流变学模型的建立
为了比较局部应力和局部毒力,建立了一个组织流变学研究模型。然而,芯片的封装结构使得无法使用流变学探针,并且与压力泵指令相比,聚二甲基硅氧烷(PDMS)支架会改变机械性能。因此,基于视频分析开发了一个可靠的数学模型来应对这些挑战。
4.2 福氏志贺氏菌的动态入侵过程
为了研究福氏志贺菌的感染动态,研究人员在感染后的 1 至 2 小时内持续进行监测,并将结果与无毒菌株(福氏志贺菌 – mxiD)进行对比。他们观察了两个关键参数:细菌菌落的扩展程度以及单个细菌侵入所需的时间。
4.2.1蠕动促进细菌定殖,使其更早开始且扩展更迅速
事实上,随着蠕动运动的发生,细菌数量显著增加(图 5A)。此外,在感染后的最初 2 小时内,TSAR(三型分泌系统激活相关指标)的激活经历了两个不同阶段,这表明在有蠕动的情况下,毒力基因会更早且更广泛地被诱导激活(图 5B)。

4.2.2 局部机械应力加速细菌在细胞间的传播
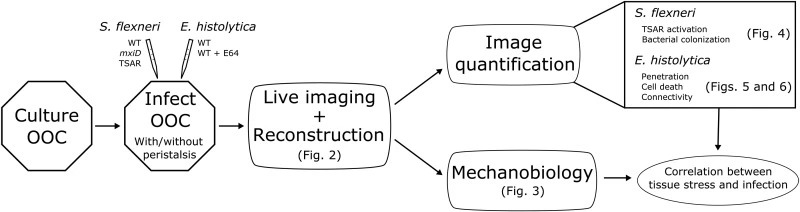
研究人员通过比较单个细菌中 TSAR 的激活速度,来探究局部机械应力对福氏志贺菌的影响。为了实现这一目的,利用蓝色膜探针 Pro12A 计算出组织的应力图谱,并将其与单个细菌的 TSAR 激活情况进行对比。如图 6 所示,研究人员观察到,在上皮应力较高的区域,细菌的激活时间明显更早。
4.3 溶组织内阿米巴原虫的动态侵袭过程
在对溶组织内阿米巴的感染研究中,研究人员采用了严格的 7 小时监测期,以 30 分钟或 1 小时为间隔进行观察,并与使用半胱氨酸蛋白酶抑制剂(E64)来防止细胞降解的对照组进行对比。研究人员观察了三个关键参数:细胞死亡情况、组织连接性以及病原体的侵入情况。
4.3.1 蠕动促进类变形虫对组织的降解和侵袭
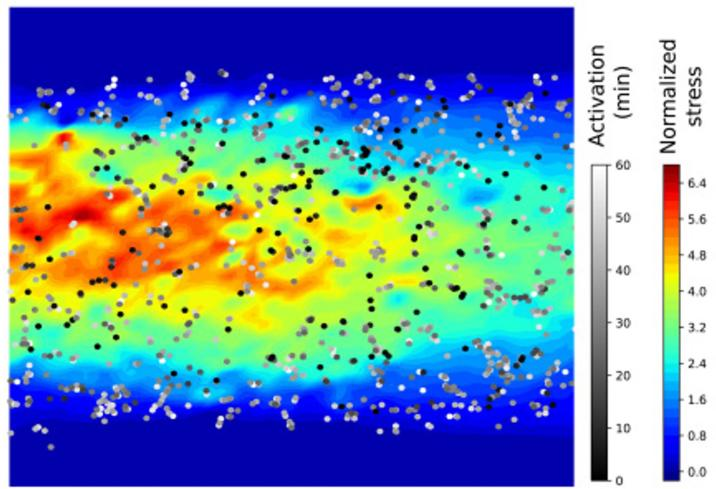
通过荧光显微镜分析发现,与静态组织(无蠕动,即 WOP)相比,在类变形虫感染 3 小时后,有蠕动(WP)的情况下细胞死亡率增加了 10%(图 7A)。为了研究组织损伤情况,研究人员还观察了细胞的连接性,结果显示在受到感染后约 3 至 4 小时出现了连接失效的情况(图 7B)。

组织降解的过程也通过荧光显微镜进行了观察(图 8)。简而言之,在感染过程中,溶组织内阿米巴(红色)降解了刷状缘上的肌动蛋白(紫色),吞噬了死亡细胞(黄色),并切断了 E – 钙黏蛋白(绿色)连接。本研究阐明,蠕动运动积极地促进了这一过程,突显了感染机制与组织力学之间的紧密联系。

溶组织内阿米巴分泌的半胱氨酸蛋白酶对于高效降解和侵入人体结肠组织至关重要。在使用半胱氨酸蛋白酶抑制剂(E64)的芯片实验条件下,无论是有蠕动(WP)还是无蠕动(WOP)的情况,都未再观察到组织降解和寄生虫侵入的现象(图 9)。这凸显了半胱氨酸蛋白酶活性在有效分解和侵入组织过程中的关键作用,同时也验证了芯片上器官(OoC)是研究阿米巴病初始阶段的一个准确模型。
4.3.2 局部机械应力增强类变形虫的入侵能力
最终研究确定,与没有蠕动的情况相比,蠕动会减少变形虫在上皮组织上的迁移,从而有助于其侵入组织。通过使用与分析局部应力相同的关联方法,将单个变形虫的侵入速度与局部应力水平进行比较后发现,从统计学角度来看,在由蠕动运动引发的较高应力区域,寄生虫侵入成功的概率更高。
5 结论
蠕动在肠道组织更新过程中发挥着作用,它能促使上皮细胞和微生物群脱落。抑制胃肠蠕动通常会导致细菌过度生长,这表明蠕动运动对于降低感染风险从根本上来说至关重要。然而,研究结果表明,尽管福氏志贺菌和溶组织内阿米巴在大小、生命周期和感染机制上存在显著差异,但蠕动运动却是这两种病原体侵入的决定性因素。这些病原体已经进化到能够利用结肠环境信号,这意味着我们需要重新审视在靶器官生态位中研究宿主与病原体相互作用的方式。蠕动运动和局部机械应力对这两种病原体感染的影响概述如图 10 所示。

引用
[1] A. Boquet-Pujadas et al., “4D live imaging and computational modeling of a functional gut-on-a-chip evaluate how peristalsis facilitates enteric pathogen invasion,” 2022. [Online]. Available: https://www.science.org//
[2] A. Grassart et al., “Bioengineered Human Organ-on-Chip Reveals Intestinal Microenvironment and Mechanical Forces Impacting Shigella Infection,” Cell Host Microbe, vol. 26, no. 3, pp. 435-444.e4, Sep. 2019, doi: 10.1016/j.chom.2019.08.007.

想要了解更多信息,请联系我们


-300x128.jpg)