研究背景
在我们的大脑中,存在一道精密而神秘的防线——血脑屏障(BBB)。这一具有高度选择性的屏障结构,如同大脑的“守门人”,保护大脑和中枢神经系统(CNS)免受有害物质的侵害,同时维持稳定的内部环境。
血脑屏障由内皮细胞、周细胞、神经胶质细胞及细胞外基质精密构成,它们协同工作,保障屏障的完整性。当这道屏障功能出现异常时,可能与阿尔茨海默病、帕金森病等神经系统疾病密切相关。如今,先进的微流控血脑屏障模型正成为神经科学与药理学研究的重要突破口,通过研发靶向疗法、识别潜在的神经毒性外源物,助力科学家更深入地探索这些疾病的奥秘[1,2]。
传统研究方法的局限与突破
传统的血脑屏障研究方法,如Transwell实验和动物模型,存在着明显的局限性:模型过于简化、生理相关性差、种属差异等问题制约了研究的深入。
微流控血脑屏障模型(μBBB)通过工程化系统模拟体内血脑屏障功能,为解决这些问题带来了新的希望。这类模型能够实现对环境的精准调控、支持细胞共培养、施加生理相关的剪切力,并高度模拟人体脑部生理条件。此外,μBBB装置还支持高分辨率成像、细胞内监测及细胞外反应分析,成为中枢神经系统疾病研究、疗法筛选及神经毒性测试的理想工具[2]。
一个优秀的体外血脑屏障模型应当能够复现体内血脑屏障的核心特征:
- 由内皮细胞构成的类血管三维结构
- 真实的细胞间相互作用
- 流体流动产生的生理性剪切力
- 薄而多孔的基底膜结构
其中,精准复现天然基底膜是最大的技术挑战之一。这一关键结构在细胞分化、内环境稳态维持、组织修复及结构支撑中发挥着不可替代的作用。理想的人工基底膜需要采用生物相容性材料,并将厚度精确控制在约100nm级别。
微流控装置设计:
一、三明治结构设计
该微流控血脑屏障设计包含上下两个聚二甲基硅氧烷(PDMS)通道,通道间由多孔膜分隔。通常采用孔径范围为 0.2-3 μm 的聚碳酸酯膜,与 Transwell 系统类似。内皮细胞一般接种在上层通道,而周细胞、星形胶质细胞或其他脑细胞则在下层通道中培养。
此外,聚四氟乙烯等替代透明膜可实现高分辨率成像,还能实时监测生物分子转运与细胞生长过程。同时,可反向调整细胞接种配置:在下层通道中,将内皮细胞培养成类血管三维结构,而上层通道接种周细胞与星形胶质细胞,这种方式能更清晰地观察细胞间相互作用。
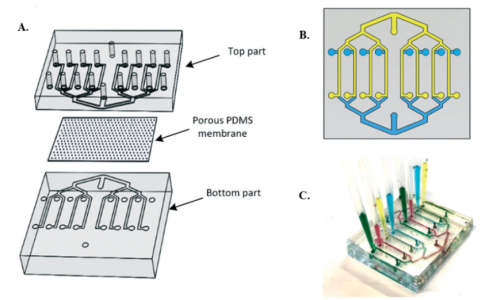
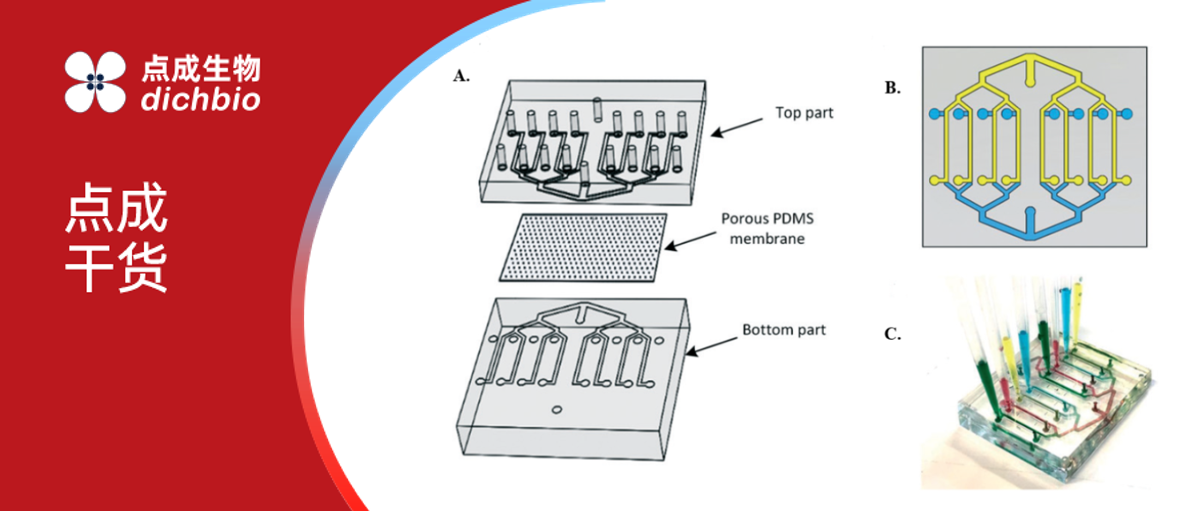
三明治结构血脑屏障芯片示意图:(A)芯片视图,包含上下两部分,每部分各有 8 条通道,通道间由多孔 PDMS 膜分隔;(B)双层装置设计示意图,由两个结构相同的 PDMS 部件组成,其中一个倒置后与另一个键合;(C)在双层装置中实现 8 种不同实验条件的示意图(2)。
二、平行结构设计
两个水平排列的通道由 PDMS 微通道阵列分隔,以 PDMS 基微柱 “膜”(间隙 3 μm)替代传统聚碳酸酯膜。该设计可实现星形胶质细胞或脑肿瘤细胞的共培养,且无需额外化学修饰,简化了装置组装流程。其平面布局还能增强细胞间相互作用,提升成像效果。
该装置的核心为中央组织腔室,两侧分布有带流体入口的血管通道,整体组装在显微镜载玻片上,通过塑料管实现各通道的流体接入。
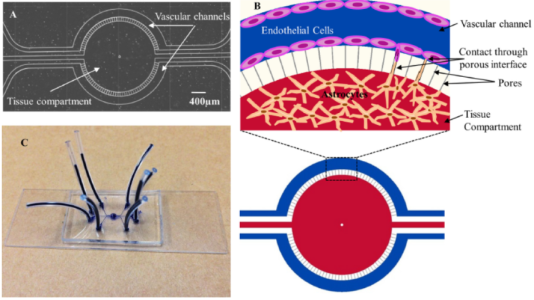
血脑屏障芯片示意图与实物图:A. 装置中心为组织腔室,两侧是两个独立的血管通道,通道设有流体入口;B. 该设计的细胞培养示意图;C. 装置组装在显微镜载玻片上,通过深蓝色塑料管连接,可分别接入各血管通道与组织腔室[3]。
三、3D 管状结构设计
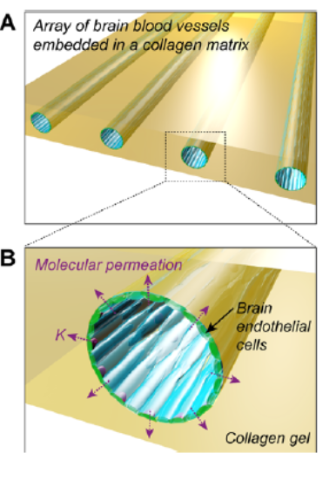
光刻技术通常用于制备基于 PDMS 的微流控血脑屏障模型,这类模型多采用矩形微通道,但矩形结构易导致流动不均与剪切力不一致,进而影响内皮细胞的生理行为。为解决这一问题,部分 μBBB 系统采用圆柱形微通道,以实现均匀的剪切力。例如,利用微针制备基于胶原蛋白的 3D 微血管管(直径 75-150 μm),通过调节流体流速可实现管径的精准控制,最终将其集成到 μBBB 装置中。
脑微血管系统示意图[4]。
实验装置与应用场景:
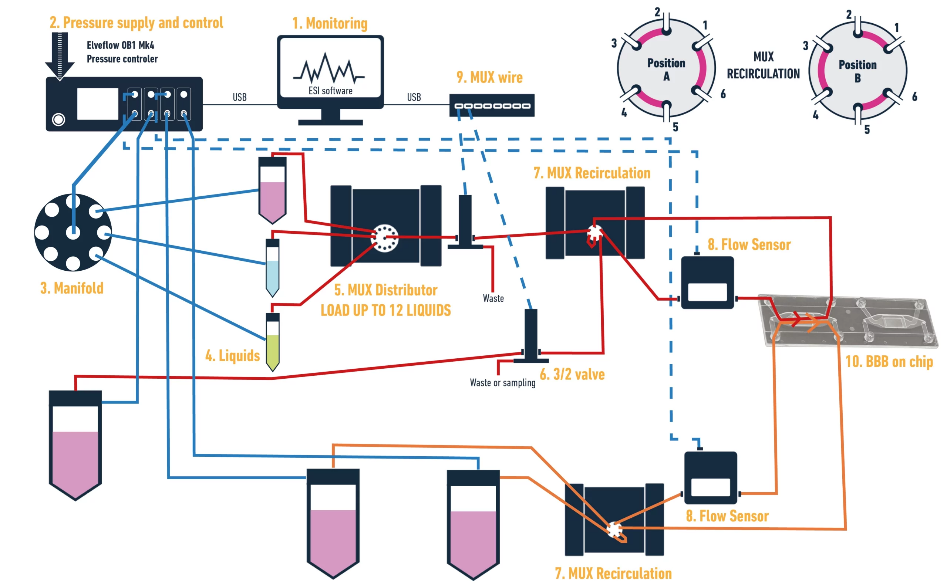
一、血脑屏障芯片集成实验装置
血脑屏障芯片(Blood-Brain Barrier on-a-chip)实验装置包含以下组件:
二、点成Elveflow 设备的实验优势
- 精准流体流量控制:OB1 采用压电调节器,可实现快速且稳定的压力调节。这种精准性能确保微流控环境高度模拟生理条件,而这对于准确复现血脑屏障的动态特性至关重要。
- 动态灌注能力:在血脑屏障芯片装置中,维持适宜的剪切力是保证内皮细胞功能正常的关键。OB1 可实现受控流体流动,进而模拟体内血流条件的动态灌注,提升模型生理相关性。
- 自动化序贯注射:该模块的阀门可按程序将多种试剂、药物或培养基输送至血脑屏障芯片中。这种自动化对于开展高度模拟体内条件的动态灌注实验至关重要,能进一步提升模型的生理相关性。
- 模拟生理流动条件:MUX 再循环模块可实现精准、可编程的流体再循环,这对复现血脑屏障内皮细胞所承受的剪切力与流体动力学环境至关重要。
- 维持细胞功能:受控的再循环能确保符合生理实际的血流模式,是维持内皮细胞形态与功能正常的必要条件。
- 药物测试与毒性筛选:可受控地引入药物或纳米颗粒,并通过再循环系统研究其与血脑屏障的长期相互作用。
- 动态共培养系统:保障持续灌注,而持续灌注对细胞活性维持与紧密连接稳定至关重要。
- 降低污染风险:闭环再循环设计大幅降低了污染风险,而污染是开放式灌注系统中常见的问题。
应用场景:
一、神经系统疾病建模(Neurological diseases Modeling)
脑肿瘤(Brain Tumor):血脑屏障模型可用于研究血管胶质瘤起始细胞,如何与其微环境相互作用。此外,利用体外血脑屏障系统能更清晰地解析脑肿瘤转移的机制。通过将患者来源的胶质母细胞瘤球状体整合到微流控系统中,这类模型可成为筛选高肿瘤杀伤能力药物的高效平台。
神经功能障碍疾病(Neurological Disorder Disease):神经系统疾病病灶处的炎症反应,源于中性粒细胞、神经胶质细胞、星形胶质细胞等免疫细胞的聚集与迁移。在阿尔茨海默病等神经功能障碍模型中,小胶质细胞与星形胶质细胞的活化会诱发神经炎症。活化的免疫细胞会释放肿瘤坏死因子 -α(TNF-α)、白细胞介素 – 1(IL-1)等炎症细胞因子。在此过程中,细胞因子与免疫细胞会导致血脑屏障破坏,常引发血液渗入脑组织,进而造成不可逆的脑损伤。
二、神经生物学研究(Neurobiology Research)
在微流控平台中调控神经细胞周围的微环境(包括细胞间相互作用与细胞 – 细胞外基质(ECM)相互作用),可为神经干细胞构建类体内微环境,助力其分化为神经系统组成细胞。将微流控技术与神经生物学结合,可解决该领域的多项技术难题,例如:中枢神经系统(CNS)神经元培养、轴突分离、培养神经元图案化、引导神经突生长以模拟轴突损伤,以及研究轴突局部蛋白质合成、轴突再生与轴突运输等过程。
三、体外药物研发(In vitro drug development)
血脑屏障芯片系统为动态、生理相关条件下评估药物通过血脑屏障的渗透性提供了先进平台,解决了传统体外模型的局限性。该系统可用于评估载药纳米颗粒,包括研究受体介导的转胞吞作用与优化中枢神经系统靶向递送的纳米载体。通过复现血脑屏障的细胞复杂性,这类模型能在疾病特异性条件下测试神经保护剂与抗体。集成传感器可实时监测药物毒性、神经元活性及突触行为。利用患者来源细胞,该系统还支持个性化药物筛选与疾病特异性研究[5]。
四、脑轴芯片(Brain-Axis on chip)
多器官芯片为研究疾病与药物研发背景下脑与其他器官的相互作用提供了先进平台。其可用于解析肺癌脑转移等复杂病症 —— 这类病症中的动态过程可通过芯片被精准复现与深入研究。此外,多器官芯片还能助力解析微生物群 – 肠 – 脑轴的通信通路,阐明肠道健康对神经系统疾病的影响。通过模拟相互关联的器官系统(如肝性脑病中的肝 – 脑轴、脑 – 脾轴介导的免疫调节),多器官芯片为理解全身性疾病提供了整合性研究手段。其模拟动态生理环境的能力,推动了器官间通信与治疗研发领域的突破性研究。
结语:
随着微流控技术的不断发展,血脑屏障芯片正在为神经系统疾病研究和药物研发开辟新的天地。点成Elveflow通过提供精准、可靠的微流控解决方案,助力科研人员突破传统研究方法的限制,更深入地探索大脑的奥秘。
References
1.X. Chen ; C. Liu ; L. Muok ; C. Zeng and Y. Li, Dynamic 3D On-Chip BBB Model Design, Development, and Applications in Neurological Diseases, Cells, 2021
2.M. Zakharova ; M. A. Palma do Carmo ; M. W. van der Helm ; H. Le-The ; M. N. S. de Graaf ; V. Orlova ; A. van den Berg ; A. D. van der Meer ; K. Broersen and L. I. Segerink, Multiplexed blood–brain barrier organ-on-chip, Lab on a Chip, 2020.
3.S. P. Deosarkar ; B. Prabhakarpandian ; B. Wang ; J. B. Sheffield ; B. Krynska and M. F. Kiani, A Novel Dynamic Neonatal Blood-Brain Barrier on a Chip, PlosOne, 2015
4.J.A. Kim ; H.N. Kim ; S-K. Im ; S. Chung ; J.Y. Kang and N.Choi, Collagen-based brain microvasculature model in vitro using three-dimensional printed template, Biomicrofluidics, 2015
5.X. Wang ; Y. Hou ; X. Ai ; J. Sun ; B. Xu ; X. Meng ; Y. Zhang and S. Zhang, Potential applications of microfluidics based blood brain barrier (BBB)-on-chips for in vitro drug development, Biomedicine & Pharmacotherapy, 2020
想要了解更多信息,请联系我们





-300x200.jpg)