血流剪切应力,是血流与血管壁摩擦产生的平行与管壁表面的切线应力,其大小取决于血液浓度、血流量及血管内径。
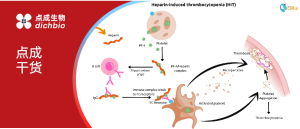
内皮细胞(EC)紧密排列在血管的管壁表面,它们时刻受着血流剪切应力的影响,并根据其在血管中不同位置对血流剪切应力作出不同基因表达反应。脉动剪切应力 (PS) 多存在于层流中,主要位于直向血管区域,而涡旋扰动或振荡剪切应力 (OS) 则多出现于血管分支口或弯曲处。
.jpg)
在动脉分支口或者弯曲处,血流由稳定的层流变为涡流或振荡流,剪切应力明显降低且方向改变。内皮功能障碍的局灶性分布对应于OS存在的区域,而内皮正常稳态则维持在PS存在的区域中,所以动脉粥样硬化多发生于动脉分支口处、动脉弯曲及狭窄处,这些研究已成为血管疾病(如动脉粥样硬化)的研究重点。
血流剪切应力是造成动脉粥样硬化病变非随机灶性分布的主要因素,许多研究显示血流剪切应力通过调控内皮细胞的基因表型来影响血管内皮结构与功能,从而影响动脉粥样硬化病变的发生发展。
有研究发现,在动脉血管分支处或者弯曲处这些好发动脉粥样硬化部位的剪切应力一般为4dyne/cm2,而不好发动脉粥样硬化部位的剪切应力通常大于12dyne/cm2。在正常生理动脉血流剪切应力(>15dyne/cm2)作用下,血管内皮细胞排列成梭形且其长轴与血流方向一致;当血流剪切应力较低(<4dyne/cm2)的情况下,内皮细胞则会呈现排列不规则的多角型,分泌内皮素、炎症介质等因子,使内皮细胞损伤,呈现动脉粥样硬化表型。
.jpg)
还有许多研究表明,内皮细胞会对局部机械信号(如剪切应力)作出反应,并与源自整个生物体的生理刺激协同作用。血管和亚血管区域协调细胞反应的现象,涉及许多疾病研究,例如肺动脉高压,阿尔茨海默病,血管性痴呆和胰腺癌等。
现代医学、生物学对于血流剪切应力的研究多借助了微流体技术,在器官芯片中模拟血管,通过微流控系统控制液体流速等因素来研究剪切应力对于细胞表达的作用。
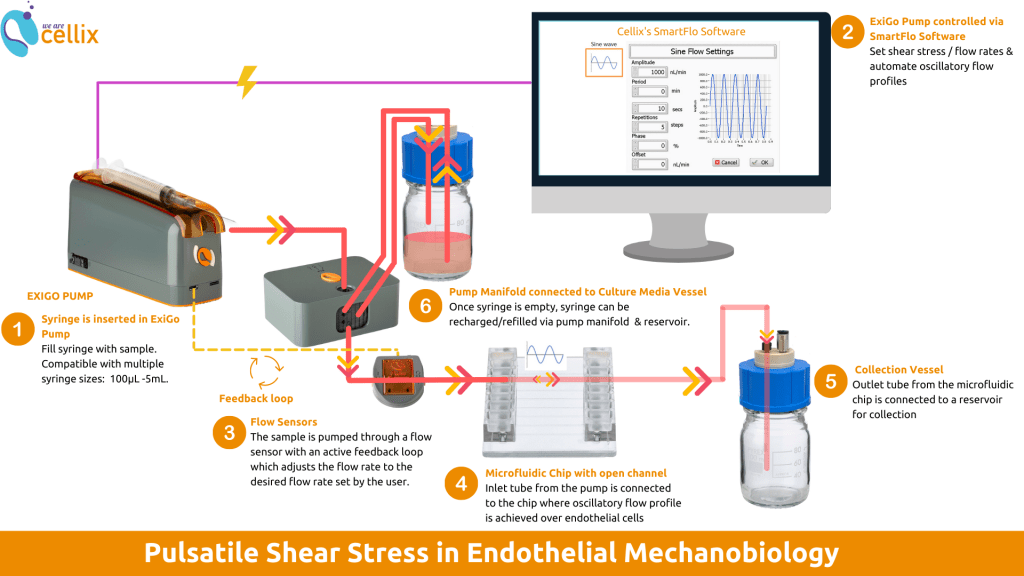
下图显示的是点成ExiGo泵和生物芯片应用于器官芯片的系统操作:
1、首先,将注射器装入ExiGo泵中。注射器规格可选范围从100微升到5毫升。
2、然后,ExiGo泵可以通过其控制软件SmartFlo软件进行控制。可以在电脑软件上自定义剪切应力和流速模式并自动执行流动过程,还可以实时监测流体情况。
3、接下来,注射器中的样品会通过流量传感器输送,该传感器将检测剪切应力和流速情况,并可根据实验实际需求进行调整。
4、样品之后会通过微流体芯片(器官芯片),在芯片里样品可以在内皮细胞上流动作用。流动模式可选,例如振荡流动模式、匀速流动等。
5、芯片之后需连接一个储液容器,用来收集从微流体芯片流出的废液。
6、当注射器中的样品液排空时,泵会通过连接到培养基容器的歧管器切换阀门并从储液瓶中抽取补充样品溶液。这可以扩展注射器的容量,并可长时间地连续进行实验。
参考文献:
1、Minge He, Marcy Martin, Tracy Marin, Zhen Chen, Brendan Gongol. Endothelial mechanobiology. APL Bioengineering 4, 010904 (2020); https://doi.org/10.1063/1.5129563
2、J. Zhang, J. Dong, M. Martin, M. He, B. Gongol, T. L. Marin, L. Chen, X. Shi, Y. Yin, F. Shang, Y. Wu, H. Y. Huang, J. Zhang, Y. Zhang, J. Kang, E. A. Moya, H. D. Huang, F. L. Powell, Z. Chen, P. A. Thistlethwaite, Z. Y. Yuan, and J. Y. Shyy, “ AMP-activated protein kinase phosphorylation of angiotensin-converting enzyme 2 in endothelium mitigates pulmonary hypertension,” Am. J. Respir. Crit. Care Med. 198, 509–520 (2018). https://doi.org/10.1164/rccm.201712-2570OC
3、R. J. Kelleher and R. L. Soiza, “ Evidence of endothelial dysfunction in the development of Alzheimer’s disease: Is Alzheimer’s a vascular disorder?,” Am. J. Cardiovasc. Dis. 3, 197–226 (2013).
4、F. Wang, Y. Cao, L. Ma, H. Pei, W. D. Rausch, and H. Li, “ Dysfunction of cerebrovascular endothelial cells: Prelude to vascular dementia,” Front. Aging Neurosci. 10, 376 (2018). https://doi.org/10.3389/fnagi.2018.00376
5、J. Luo, P. Guo, K. Matsuda, N. Truong, A. Lee, C. Chun, S. Y. Cheng, and M. Korc, “ Pancreatic cancer cell-derived vascular endothelial growth factor is biologically active in vitro and enhances tumorigenicity in vivo,” Int. J. Cancer 92, 361–369 (2001). https://doi.org/10.1002/ijc.1202
6.McGuigan, P. Kelly, R. C. Turkington, C. Jones, H. G. Coleman, and R. S. McCain, “ Pancreatic cancer: A review of clinical diagnosis, epidemiology, treatment and outcomes,” World J. Gastroenterol. 24, 4846–4861 (2018). https://doi.org/10.3748/wjg.v24.i43.4846
7.张焰,郑振声,马虹,伍富贵.提高血流剪切应力调控动脉粥样硬化相关基因表达[J].心血管病学进展.2009,30:728-730