原生质体是通过酶解或机械方法去除细胞壁的植物细胞。这些无细胞壁的球形植物细胞具有全能性等独特特性,使其成为植物科学研究的多功能工具。它们可作为实验系统可用于探索植物细胞的结构、化学特性及功能。
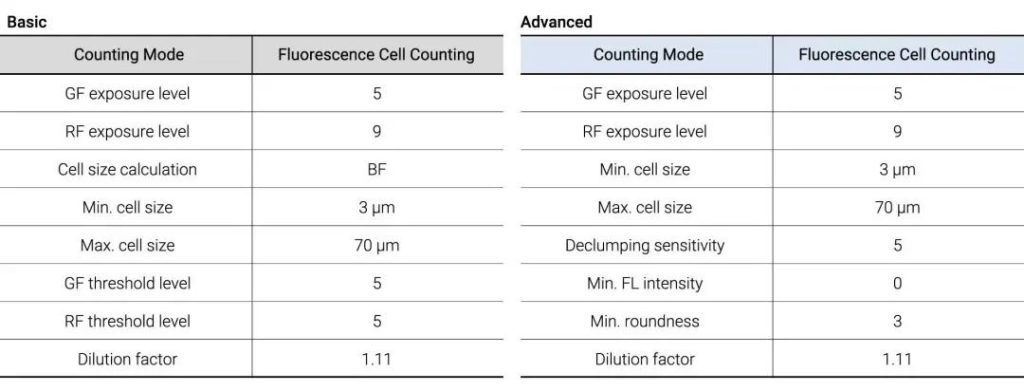
传统活力评估需将原生质体培养至发育成完整植株,但该方法无法实现即时的活力评估。点成LUNA-FX7™自动细胞计数仪用不同颜色的荧光染料,通过双重染色法快速测定活力,但需了解该设备在不同染料条件下的表现并调整分析参数。本研究旨在确定使用点成LUNA-FX7™自动细胞计数仪评估原生质体活力的最佳染料组合及参数设置。
1. 原生质体分离与染色
原生质体分离步骤
1.准备5克幼苗,依次用乙醇和蒸馏水各清洗1次和2次。2.用纸巾吸干水分后置于培养皿中,用剪刀细切。3.加入25ml消化缓冲液混匀,转移至50ml离心管并用锡箔纸遮盖避光。4.置于摇床上以20转/每分钟转速培养6小时。5.培养后加入20ml洗涤缓冲液,轻轻混匀后经100 μm滤网过滤。6.100 g离心3分钟。7.去除上清液,加20ml洗涤缓冲液混匀后经40 μm滤网过滤。8.再次100 g离心3分钟。9.去除上清液,用3ml洗涤缓冲液重悬沉淀。
荧光染色步骤
1. 混合:
18 μL原生质体细胞
2 μL绿/红荧光染料等体积混合液
2. 2.取10 μL染色细胞悬液样本上样
3. 使用点成LUNA-FX7™进行分析
* 注意:原生质体尺寸差异大,可能表现出不同的荧光强度。请根据需要进行调整
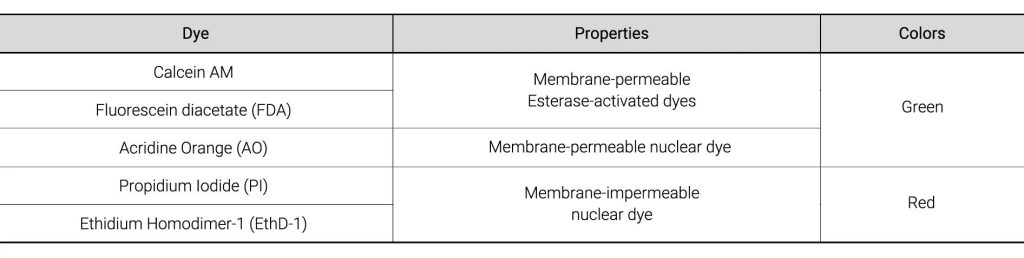
2. 用于活性测定的染料
我们选择了五种常用的用于活性评估的染料:
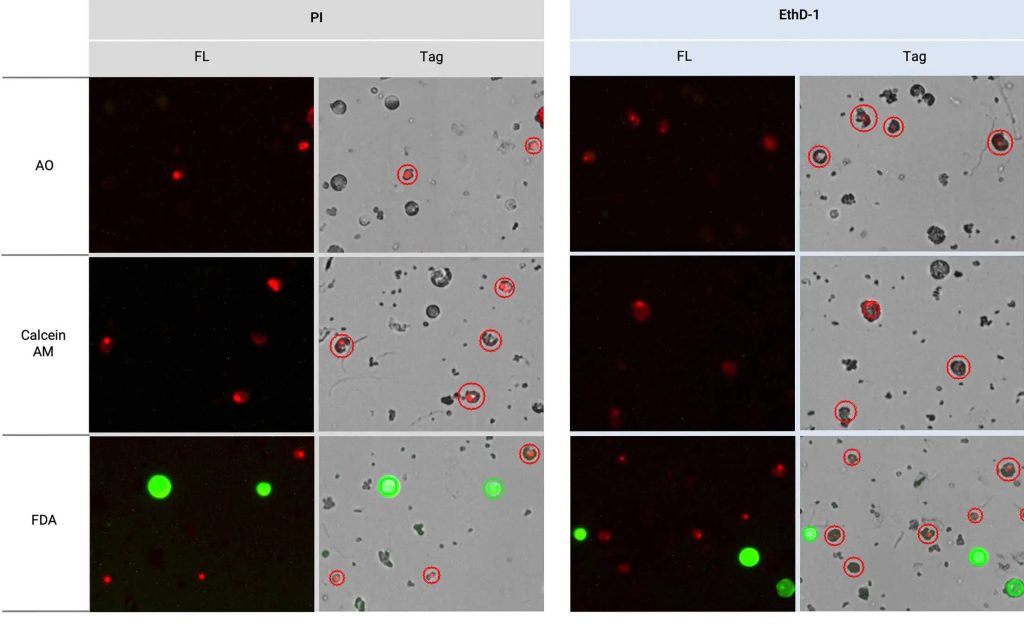
3. 原生质体活力评估的最佳荧光染料组合
FDA/PI或FDA/EthD-1是原生质体活力评估的最佳选择(图1)。PI和EthD-1均能有效染色原生质体核,但需要将红光曝光水平调至9才能检测到充足信号(表1)。
在测试的绿色荧光染料中,仅FDA无需调整绿光曝光水平即可产生明亮可靠的信号。FDA和Calcein AM虽均依赖酯酶活性产生信号,但Calcein AM几乎无信号响应。需特别注意的是,FDA在持久培养时间中可能产生较高的背景噪音,建议在染色后立即进行细胞计数,以获得最佳的活力评估结果。如果信号过强,可以通过调整绿光曝光水平进行优化。此外,尽管AO通常被认为能染色所有细胞,但其荧光强度显著降低。
4. 缓冲液对绿色荧光染料性能的影响
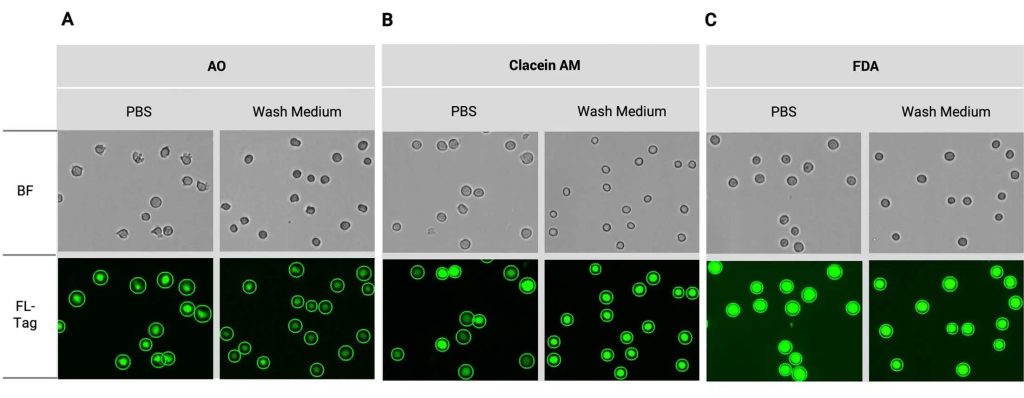
尽管AO能够染色所有细胞(无论死活),但其在原生质体中低信号异常促使我们进一步研究。我们在哺乳动物细胞(如U937细胞)上使用绿色染料进行实验,并使用PBS或洗涤培养基作为缓冲液,采用默认分析方案评估缓冲液对染料信号的影响。结果显示:AO信号强度在洗涤缓冲液中较PBS显著降低(图2A);Calcein AM在洗涤缓冲液中信号稳定性提升,FDA信号受缓冲液类型影响较小,仅强度轻微下降(图2B和图2C)。
导致这些差异的具体因素尚不明确,但缓冲液的渗透压和pH值差异可能会影响细胞状态和染料性能。例如,AO在不同pH值下可能显示不同颜色。而渗透压的差异会使细胞大小从13 µm左右缩小至1-2 µm。综合考虑这些因素,化学条件的变化可能通过多种机制影响染料表现。
结论
FDA/PI或DA/EthD-1是最有效的原生质体染色活力评估组合。FDA始终产生可靠的信号,但应在染色后立即进行细胞计数,以尽量减少培养期间的噪音。Calcein AM的性能因细胞类型和缓冲液而异。值得注意的是,AO信号在洗涤培养基中显著降低。此外,PI和EthD-1对原生质体的染色效果良好,但需将红光曝光水平从5调至9。
总之,点成LUNA-FX7™自动细胞计数仪通过优化染料组合与分析参数,可为原生质体活力评估提供高效解决方案。


想要了解更多信息,请联系我们